Auf die Frage, was bei der Seifenherstellung für chemische Prozesse ablaufen, habe ich schon viele, sehr spannende Antworten gehört und ziemlich häufig bekomme ich zur besseren Erklärung dann schnell mal ein Bild vorgesetzt, welches seinen Ursprung wahrscheinlich auf irgend einer Internetseite hat und nun immer wieder aus dem Ärmel gezaubert wird, wenn es gilt, mich (oder andere Leute) mit chemischen Formeln und Fachwissen zu beeindrucken. Es sieht ungefähr so aus:
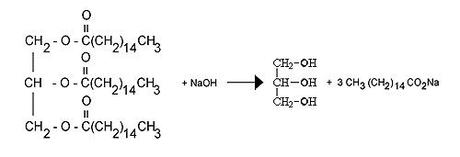
Alles klar, möchte man sagen, völlig logisch. Ch2, dann ein O, noch ein C, eine Klammer mit CH2, dahinter 14 (was eigentlich?) und nicht das NaOH vergessen. Was zum Kuckuck ist NaOH eigentlich? Schnell mal Wikipedia fragen: “Ätznatron (kaustisches Soda), ist ein weißer, hygroskopischer Feststoff.” Alle Fragen auf einen Schlag beantwortet – scheinbar -, denn manchmal juckt mir das Fell und ich will dann unbedingt wissen, wo sich das Glycerin versteckt und welcher Teil der Formel für die Verseifung wichtig ist. Man sollte nämlich wenigstens wissen, was die einzelnen Symbole der Abbildung bedeuten.
Hier mit einer kleinen Ergänzung:
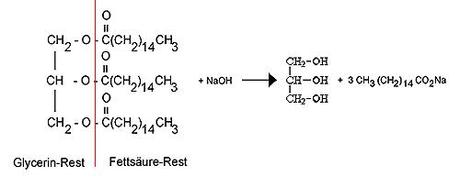
Und gerade weil ich kein Chemiker bin, suche ich für mich immer nach etwas einfacheren Erklärungen und Bildern, die ich selber verstehe und mit deren Hilfe ich interessierten Menschen in groben Zügen erklären kann, was bei der Seifenherstellung im Kochtopf eigentlich passiert. Die großspurig dahingeworfene Formel, irgendwo aus dem Internet herauskopiert, überzeugt und beeindruckt mich jedenfalls nur wenig. Entscheidend für die Seifenherstellung sind nämlich die Fettsäuren. Folgen sie mir zu einer einfachen, verständlichen Erklärung. Schließlich läßt sich die Frage, woraus Seife (wenn schon nicht aus Knochen) eigentlich gemacht wird, auch ganz einfach beantworten. Erste, ganz einfache Erklärung: Fett(säure), pflanzlich und/ oder tierisch (organisch und sauer). + Lauge (NaOH/ Natriumhydroxid), anorganisch und basisch (Natrium ist ein Salz) = Seife.
Und für alle, die es nun doch etwas genauer wissen möchten, male ich die Sache jetzt mal so auf, wie ich es für sinnvoll halte. Teil 1, die Fettsäure:
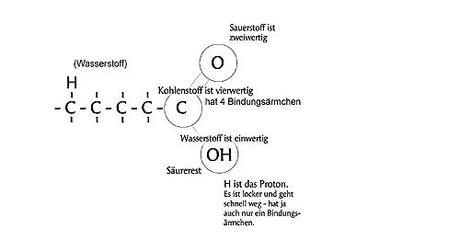
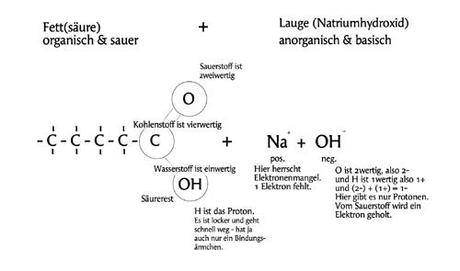
Hier haben wir die Fettsäure. Ich finde es leichter, wenn man die Abbildung (im Gegensatz zur obigen Darstellung) spiegelt und das Schwänzchen aus Kohlenstoffatomen (C) nach links zeigt. Für sich betrachtet handelt es sich bei meiner Zeichnung um ein Molekül. Die fehlenden H `s (Wasserstoffatome) an der Kette aus C `s (Kohlenstoff) kann man sich leicht dazudenken. Kohlenstoff ist vierwertig, weil er vier Bindungsärmchen hat (2 Bindungsärmchen gehen zum Sauerstoff O nach oben, und ein Bindungsärmchen geht zur Hydroxidgruppe OH nach unten). Sauerstoff ist zweiwertig (weil ihn 2 Bindungsärmchen am Kohlenstoff C festhalten). In der Hydroxidgruppe OH sind Sauerstoff und Wasserstoff gebunden – diese ist neutral, weil keine freien Elektronen vorhanden sind. Die Länge des Schwänzchen unterscheidet sich von Fett zu Fett und ist für uns grad völlig unwichtig. Von Interesse ist nur der vordere Bereich. So kann man jedenfalls schon mal den Teil der Fettsäure erklären. Alle anderen Inhaltsstoffe eines Fettes sind nicht weiter von Bedeutung. Da werden jetzt sicher einige widersprechen wollen. Kein Problem, nur dann hätte ich gern eine verständliche Erläuterung der obigen Abbildung.
Teil 2. NaOH (Natriumhydroxid):
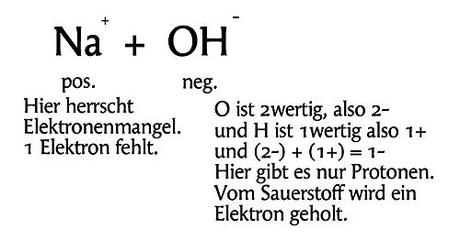
Die Lauge (NaOH) wird aus den weißlichen Plätzchen, den Rotulis, und Wasser (H2O) hergestellt. Wobei für unsere Abbildung, für die einfache Erläuterung, das NaOH absolut ausreicht (ein Na reicht um ein OH zu binden). Ganz genau sollte es so aussehen: Na + H20 -> NaOH + H2, weil bei Reaktionen, wo Laugen/Basen entstehen, kommt immer Wasserstoff oder Wasser heraus. Bei uns ist es Wasserstoff und H kommt molekular vor, also H2. Aber das ist eigentlich gar nicht wichtig. Was ist NaOH? Einfach ausgedrückt handelt es sich dabei um ein Salz, was zumeist wohl aus Natriumchlorid (NaCL, in der Natur im Meerwasser enthalten) gewonnen wird. Natrium und Kalium z.B. kennen wir auch als Elektrolyte. Die Hydroxidgruppe OH (negativ geladen) macht die Verbindung basisch. Na ist positiv geladen. Hier herrscht Elektronenmangel, weil genau 1 Elektron fehlt. So sieht es aus.
Bis zu diesem Punkt sieht es also so aus: Links die Fett(säure) + die Lauge NaOH.
Und jetzt wird es spannend, weil nun, wenn Fettsäure und Lauge zusammenkommen, die Verseifung/ die Veresterung beginnt. Ester sind übrigens eine Stoffgruppe, die recht häufig ganz gut riechen.
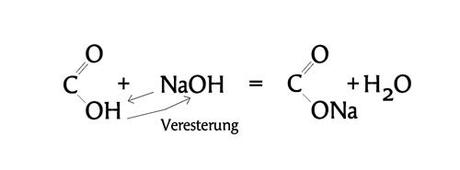 Die Abbildung zeigt den wichtigen Teil der Reaktion. Das lange Schwänzchen aus Kohlenstoff- und Wasserstoffatomen ist völlig unwichtig und wird weggelassen, weil ich gerade nicht von einem ganz bestimmten Fett/ Öl spreche, sondern nur von einem X-beliebigen Fett. Von Interesse ist nur der vordere Teil, bestehend aus Kohlenstoff (C/ vierwertig), Sauerstoff (O/ zweiwertig) und der Hydroxidgruppe (OH/ einwertig), und dazu das NaOH.
Die Abbildung zeigt den wichtigen Teil der Reaktion. Das lange Schwänzchen aus Kohlenstoff- und Wasserstoffatomen ist völlig unwichtig und wird weggelassen, weil ich gerade nicht von einem ganz bestimmten Fett/ Öl spreche, sondern nur von einem X-beliebigen Fett. Von Interesse ist nur der vordere Teil, bestehend aus Kohlenstoff (C/ vierwertig), Sauerstoff (O/ zweiwertig) und der Hydroxidgruppe (OH/ einwertig), und dazu das NaOH.
Was passiert an dieser Stelle? Was zeigt die Abbildung?
Als erstes geht das lockere Proton H des Wasserstoffs weg und verbindet sich mit OH zu H2O. Und weil das Na nun frei wird, dockt es einfach am Säurerestion (CO2-) an. Im Prinzip geht es bei solchen Reaktionen immer nur um einen Ladungsausgleich, um stabile Verbindungen.
Und das Ergebnis = Seife.
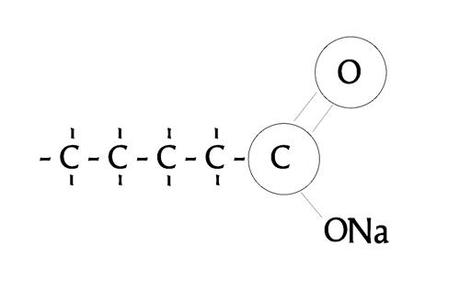
Und wer jetzt schlau ist, der betrachtet mal nur die linke und die recht Bildhälfte und fragt, warum das O an seinem Platz geblieben ist. Na ganz einfach, weil Doppelbindungen stabiler sind als einfache Bindungen (die Bindungsärmchen muß man sich jetzt einfach mal dazudenken. 2 nach oben und eins nach unten).
Und nun noch einmal alles auf einen Blick:
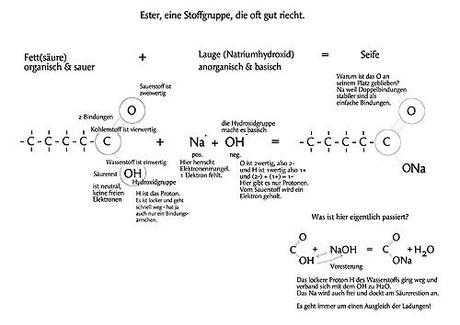
Sicher, es ist trotzdem nicht ganz einfach und wer mit positiven und negativen Ladungen, mit Elektronen, Protonen und Molekülen so gar nichts anfangen kann, der wird auch das hier vielleicht nicht verstehen. Aber im Grunde genommen ist es gar nicht so wichtig, weil die Verseifung im Kochtopf trotzdem gelingt und viel Freude bereiten kann. Nur manchmal ist es halt einfacher, wenn man mit einigen Strichen, Kreisen, Zeichen (Buchstaben und Zahlen), kurz erläutert, wie sich die Dinge so zusammenfügen.

